Pengertian Tatanama Senyawa
Tatanama IUPAC adalah sistem penamaan senyawa kimia dan penjelasan ilmu kimia secara umum. Tatanama ini dikembangkan dan dimutakhirkan di bawah pengawasan International Union of Pure and Applied Chemistry (IUPAC) oleh UNESCO-PBB.
Tata Nama Senyawa Ion
Ikatan ion adalah ikatan yang terbentuk antara ion positif dan ion negative.
Ion positif disebut juga sebagai kation, dapat berupa kation monoatomik/ion logam (Na+, K+, Li+, Ca2+, Mg2+ dan Al3+) maupun kation poliatomik (NH4+).
Ion negative disebut juga sebagai anion, dapat berupa anion monoatomik/ion non logam (F–, Cl–, Br–, I–, O2- dan S2-) maupun anion poliatomik (NO3-, CO32-, SO42- dan PO43-).
Nama senyawa ion adalah rangkaian nama kation (di depan) dan nama anion (di belakang), angka indeks tidak disebut.
Contoh:
- NaCl = natrium klorida
- CaCl2 = kalsium klorida
- Na2SO4 = natrium sulfat
- Al(NO3)3 = aluminium nitrat
Jika unsur logam mempunyai lebih dari satu jenis bilangan oksidasi, maka senyawa-senyawanya dibedakan dengan menuliskan bilangan oksidasinya, yang ditulis dalam tanda kurung dengan angka Romawi di belakang nama unsur logam tersebut. Contoh:
- Cu2O = tembaga(I) oksida
- CuO = tembaga(II) oksida
- FeCl2 = besi(II) klorida
- FeCl3 = besi(III) klorida
- Fe2S3 = besi(III) sulfida
- SnO = timah(II) oksida
- SnO2 = timah(IV) oksida
Tatanama Senyawa Organik
-
Alkana
Alkana merupakan senyawa hidrokarbon dengan ikatan tunggal.
Aturan penamaan senyawa alkana :
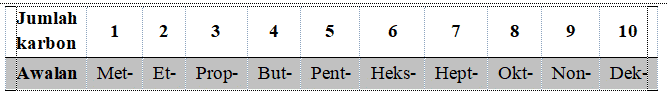
Alkana memiliki akhiran “-ana” dan diberikan awalan tergantung pada jumlah atom dalam rantai tersebut mengikuti aturan imbuhan pengganda IUPAC
- Menentukan rantai induk, yaitu rantai karbon terpanjang.
- Penomoran rantai induk dimulai dari ujung terdekat cabang.
- Menentukan nomor cabang pada rantai induk.
- Memberi nama cabang yang merupakan gugus alkil.
Tata Nama Senyawa Biner
Senyawa biner merupakan yang tersusun dari dua unsur. Unsur tersebut dapat berupa logam dengan non logam atau keduanya non logam.
-
Tata Nama Senyawa Biner Logam-Nonlogam
Untuk senyawa biner yang terdiri dari logam dan nonlogam yang hanya mempunyai satu bilangan oksidasi atau senyawa ionik penamaannya adalah unsur logam ditulis atau disebutkan terlebih dahulu kemudian diikuti oleh unsur non logam ditambah akhiran –ida. Beberapa contoh senyawa biner logam dan non logam dapat dilihat pada tabel
Untuk unsur logam yang mempunyai bilangan oksidasi lebih dari satu (umumnya logam transisi), penamaanya adalah menulis atau menyebut nama logam terlebih dahulu diikuti dengan angka Romawi yang diberi tanda kurung kemudian diikuti dengan nama unsur nonlogam, ditambah akhiran –ida. Metode ini dikenal dengan sistem stock dan dapat dipakai untuk setiap senyawa biner dari logam dan nonlogam, namun pada senyawa ionik dengan satu bilangan oksidasi jarang digunakan bahkan tidak pernah disebutkan.
-
Tata Nama Senyawa Biner Nonlogam
Untuk penamaan senyawa biner yang dbentuk dari dua unsur nonlogam penamaannya adalah menyebut atau menulis unsur yang cenderung bermuatan positif (umumnya memiliki bilangan oksidasi positif) kemudian diikuti dengan unsur yang cenderung bermuatan negati (umumnya memiliki bilangan oksidasi negatif), ditambah akhiran -ida. Berikut adalah urutan penulisan atau penamaan untuk senyawaan biner dari nonlogam:
B ─ Si ─ C ─ Sb ─ As ─ P ─ N ─ H ─ Te ─ Se ─ S ─ I ─ Br ─ Cl ─ O ─ F
Unsur-unsur yang ada disebelah kiri dari suatu unsur maka ditulis atau disebut terlebih dahulu.
Senyawa biner nonlogam yang hanya membentuk satu senyawa dengan atom lain penamaan adalah menyebut atau menulis terlebih dahulu unsur yang cenderung bermuatan positif diikuti unsur yang cenderung bermuatan negatif ditambah akhiran -ida.
Tatanama Senyawa Poliatomik
Senyawa poliatomik adalah senyawa yang berasal dari ion-ion poliatomik. Ion poliatom adalah ion yang terdiri atas dua atau lebih atom-atom yang terikat bersama-sama membentuk ion dengan ikatan kovalen. Senyawa poliatomik umumnya terdiri atas unsur-unsur nonlogam.
Tata Nama Senyawa Alkana
Perbedaan rumus struktur alkana dengan jumlah C yang sama akan menyebabkan berbedaan sifat alkana yang bersangkutan. Banyaknya kemungkinan struktur senyawa karbon, menyebabkan perlunya pemberian nama yang dapat menunjukkan jumlah atom C dan rumus strukturnya. Aturan pemberian nama hidrokarbon telah dikeluarkan oleh IUPAC agar dapat digunakan secara internasional.
Aturan tata nama alkana
- Rantai tidak bercabang (lurus) Jika rantai karbon terdiri dari 4 atom karbon atau lebih, maka nama alkana diberi alawal n- (normal)
CH3 CH2 CH2 CH2 CH3 = n-pentana
- Jika rantai karbon bercabang, maka:
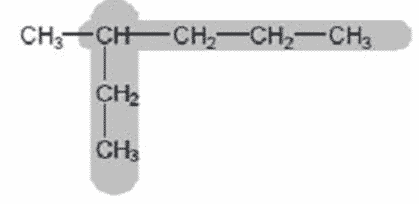
- Tentukan rantai induk, yaitu rantai karbon terpanjang dari ujung satu ke ujung yang lain. Rantai induk diberi nama alkana.
rantai induk terdiri dari 6 atom C, sehingga diberi nama heksana
- Penomoran.
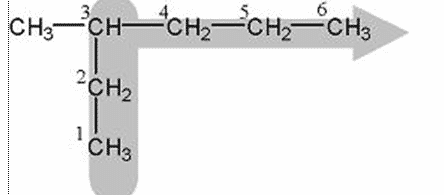
Berilan nomor pada rantai induk dari ujung terdekat cabang.
Jika nomor dari bawah, maka cabang ada di nomor 3. tetapi jika dari kanan, maka cabang ada di nomor 4. Sehingga dipilih penomoran dari ujung bawah.
- Tentukan cabang, yaitu atom C yang yang terikat pada rantai induk. Cabang merupakan gugus alkil dan beri nama alkil sesuai struktur alkilnya. Perhatikan beberapa gugus alkil berikut:
- Tabel 3. Nama Alkil
Ikatan Kovalen
Ikatan kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk melepaskan elektron (terjadi pada atom-atom non logam).
Gagasan ikatan kovalen dikemukakan oleh Gilbert N.Lewis yang pada tahun 1916 menjelaskan pembagian pasangan elektron di antara atom-atom. Dia memperkenalkan Struktur Lewis atau notasi titik elektron atau struktur titik Lewis yang menggunakan titik-titik di sekitar simbol atom untuk mewakili elektron valensi terluar atom. Pasangan elektron yang berada di antara atom-atom mewakili ikatan kovalen. Pasangan berganda mewakili ikatan berganda, seperti ikatan rangkap dua dan ikatan rangkap tiga.
Jenis Ikatan Kovalen
-
Ikatan Kovalen Tunggal
Contoh: 1H = 1 dan 9F = 2, 7
Atom H memiliki 1 elektron valensi sedangkan atom F memiliki 7 elektron valensi. Agar atom H dan F memiliki konfigurasi elektron yang stabil, maka atom H dan atom F masing-masing memerlukan 1 elektron tambahan (sesuai dengan konfigurasi elektron He dan Ne). Jadi, atom H dan F masing-masing meminjamkan 1 elektronnya untuk dipakai bersama
-
katan Kovalen Rangkap Dua
Contoh:
Ikatan yang terjadi antara atom O dengan O membentuk molekul O2 Konfigurasi elektronnya : 8O= 2, 6 Atom O memiliki 6 elektron valensi, maka agar diperoleh konfigurasi elektron yang stabil tiap-tiap atom O memerlukan tambahan elektron sebanyak 2. Ke-2 atom O saling meminjamkan 2 elektronnya, sehingga ke-2 atom O tersebut akan menggunakan 2 pasang elektron secara bersama.
-
Ikatan Kovalen Rangkap Tiga
Contoh:
Ikatan yang terjadi antara atom N dengan N membentuk molekul N2 Konfigurasi elektronnya : 7N = 2, 5 Atom N memiliki 5 elektron valensi, maka agar diperoleh konfigurasi elektron yang stabil tiap-tiap atom N memerlukan tambahan elektron sebanyak 3. Ke-2 atom N saling meminjamkan 3 elektronnya, sehingga ke-2 atom N tersebut akan menggunakan 3 pasang elektron secara bersama.
-
Ikatan Kovalen Koordinasi / Koordinat / Dativ
Adalah ikatan yang terbentuk dengan cara penggunaan bersama pasangan elektron yang berasal dari salah 1 atom yang berikatan [Pasangan Elektron Bebas (PEB)], sedangkan atom yang lain hanya menerima pasangan elektron yang digunakan bersama. Pasangan elektron ikatan (PEI) yang menyatakan ikatan dativ digambarkan dengan tanda anak panah kecil yang arahnya dari atom donor menuju akseptor pasangan elektron.
Contoh: Terbentuknya senyawa BF3 – NH3
Demikianlah artikel dari duniapendidikan.co.id mengenai Tatanama Senyawa : Organik, Ion, Biner, Poliatomik, Alkana, Kovalen, semoga artikel ini bermanfaat bagi anda semuanya.