Pengertian Sel Elektrolis
Sel Elektrolisis adalah sel yang menggunakan arus listrik untuk menghasilkan reaksi redoks yang diinginkan dan digunakan secara luas di dalam masyarakat kita. Baterai aki yang dapat diisi ulang merupakan salah satu contoh aplikasi sel elektrolisis dalam kehidupan sehari-hari. Baterai aki yang sedang diisi kembali (recharge) mengubah energi listrik yang diberikan menjadi produk berupa bahan kimia yang diinginkan. Air, H2O, dapat diuraikan dengan menggunakan listrik dalam sel elektrolisis. Proses ini akan mengurai air menjadi unsur-unsur pembentuknya. Reaksi yang terjadi adalah sebagai berikut : 2 H2O(l) ——> 2 H2(g) + O2(g)
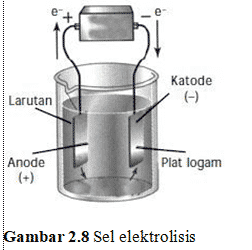
Rangkaian sel elektrolisis hampir menyerupai sel volta. Yang membedakan sel elektrolisis dari sel volta adalah, pada sel elektrolisis, komponen voltmeter diganti dengan sumber arus (umumnya baterai). Larutan atau lelehan yang ingin dielektrolisis, ditempatkan dalam suatu wadah. Selanjutnya, elektroda dicelupkan ke dalam larutan maupun lelehan elektrolit yang ingin dielektrolisis. Elektroda yang digunakan umumnya merupakan elektroda inert, seperti Grafit (C), Platina (Pt), dan Emas (Au). Elektroda berperan sebagai tempat berlangsungnya reaksi.
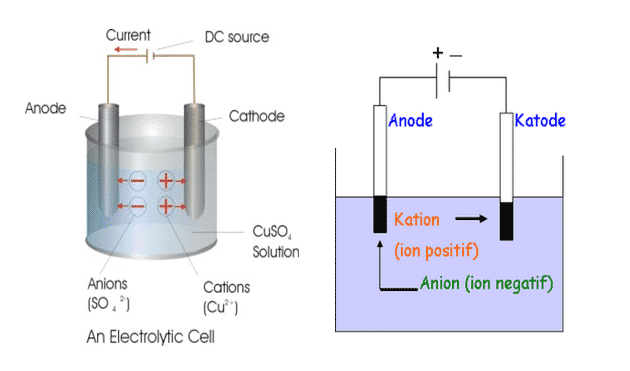
Reaksi reduksi berlangsung di katoda, sedangkan reaksi oksidasi berlangsung di anoda. Kutub negatif sumber arus mengarah pada katoda (sebab memerlukan elektron) dan kutub positif sumber arus tentunya mengarah pada anoda. Akibatnya, katoda bermuatan negatif dan menarik kation-kation yang akan tereduksi menjadi endapan logam. Sebaliknya, anoda bermuatan positif dan menarik anion-anion yang akan teroksidasi menjadi gas. Terlihat jelas bahwa tujuan elektrolisis adalah untuk mendapatkan endapan logam di katoda dan gas di anoda.
Prinsip Elektrolisis
Elektrolisis artinya penguraian suatu zat akibat arus listrik. Zat yang terurai dapat berupa padatan, cairan, atau larutan. Arus listrik yang digunakan adalah arus searah (direct current =dc ). Tempat berlangsungnya reaksi reduksi dan oksidasi dalam sel elektrolisis sama seperti pada sel volta, yaitu anode (reaksi oksidasi) dan katode (reaksi reduksi). Perbedaan sel elektrolisis dan sel volta terletak pada kutub elektrode.
Pada sel volta, anode (–) dan katode (+), sedangkan pada sel elektrolisis sebaliknya, anode (+) dan katode (–). Pada sel elektrolisis anode dihubungkan dengan kutub positif sumber energi listrik, sedangkan katode dihubungkan dengan kutub negatif. Oleh karena itu pada sel elektrolisis di anode akan terjadi reaksi oksidasi dan dikatode akan terjadi reaksi reduksi.
Ketika kedua elektrode karbon dihubungkan dengan sumber energi listrik arus searah, dalam sel elektrolisis terjadi reaksi redoks, yaitu penguraian air menjadi gas H2 dan gas O2.
Reaksi redoks yang terjadi dalam sel elektrolisis adalah
Anode (+): 2H2O(l) ⎯⎯→ O2(g) + 4H+(aq) + 4e– (oksidasi O2–)
Katode (–): 4H2O(l) + 4e– ⎯⎯→2H2(g) + 4OH–(aq) (reduksi H+)
Reaksi : 2H2O(l) ⎯⎯→ 2H2(g) + O2(g)
Berapakah perbandingan volume gas H2 dan O2 yang terbentuk pada kedua tabung reaksi?
Berdasarkan persamaan reaksi redoks dapat diramalkan bahwa perbandingan volume gas H2 terhadap O2 adalah 2 : 1. Jika volume gas H2 20 mL, volume gas O2 adalah 10 mL. Alat yang akurat untuk penyelidikan elektrolisis air adalah alat elektrolisis Hoffman (Gambar 2.9). Alat ini dilengkapi elektrode platina dalam tabung penampung gas berskala sehingga volume gas hasil elektrolisis mudah diukur.
Gambar Sel Elektrolis
Contoh Menentukan Reaksi Redoks dalam Sel Elektrolisis
Tuliskan reaksi sel elektrolisis untuk larutan ZnSO4.
Jawab:
Di anode terjadi persaingan antara ion SO42– dan H2O dan di katode terjadi persaingan antara ion Zn2+ dan H2O. Untuk mengetahui pemenangnya dapat dilihat data potensial reduksi standar.
Di katode (+): reaksi reduksi
Zn2+(aq) + 2e– ⎯⎯→ Zn(s) E° = –0,76 V
2H2O(l) + 2e– ⎯⎯→ H2(g) + 2OH–(aq) E° = –0,83 V
Di anode (–): reaksi oksidasi
2SO42–(aq) ⎯⎯→ S2O82–(aq) + 2e– E° = –2,01 V
2H2O(l) ⎯⎯→ O2(g) + 4H+(aq) + 4e– E° = –1,23 V
Berdasarkan data potensial di atas, di katode terjadi reduksi ion Zn2+ dan di anode terjadi oksidasi H2O. Persamaan reaksinya:
Katode: 2Zn2+(aq) + 4e– → 2Zn(s)
Anode: 2H2O(l) → O2(g) + 4H+(aq) + 4e–
Reaksi: 2ZnSO4(aq) + 2H2O(l) → 2Zn(s) + O2(g) + 2H2SO4(aq)
Kegunaan Sel Elektrolisis
-
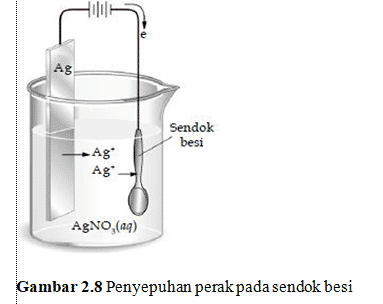
Sel elektrolisis pada Penyepuhan logam
Penyepuhan logam bertujuan melapisi logam dengan logam lain agar tidak mudah berkarat. Contohnya, penyepuhan perak yang biasa dilakukan pada peralatan rumah tangga, seperti sendok, garpu, dan pisau. Pada penyepuhan perak, logam perak bertindak sebagai katode dan sendok besi bertindak sebagai anode.
Contoh lainnya adalah pada kendaraan bermotor, biasanya mesin kendaraan bermotor yang terbuat dari baja dilapisi dengan kromium. Proses pelapisan kromium dilakukan dengan elektrolisis, larutan elektrolit disiapkan dengan cara melarutkan CrO3 dengan asam sulfat encer. Kromium(VI) akan tereduksi menjadi kromium(III) lalu tereduksi menjadi logam Cr.
CrO3(aq) + 6 H+(aq) + 6 e– → Cr(s) + 3 H2O(l)
-
Produksi Aluminium
Sel elektrolisis pada produksi Aluminium diperoleh dengan cara elektrolisis bijih aluminium. Reaksi yang terjadi sebagai berikut.
Katode : Al3+(aq) + 3 e– → Al(l)
Anode : 2 O2–(aq) → O2(g) + 4 e–
4 Al3+(aq) + 6 O2–(aq) → 4 Al(l) + 3 O2(g)
-
Produksi natrium
Sel elektrolisis pada produksi Natrium diperoleh dengan cara elektrolisis lelehan NaCl yang dikenal dengan Proses Down. Reaksi yang terjadi sebagai berikut.
Katode : 2 Na+(l) + 2 e– → 2 Na(l)
Anode : 2 Cl–(l) → Cl2(g) + 2 e–
2 Na+(aq) + 2 Cl–(aq) → 2 Na(l) + Cl2(g)
Demikianlah artikel dari duniapendidikan.co.id mengenai Sel Elektrolisis : Gambar, Susunan, Kegunaan, Prinsip, Contoh, Pengertian, semoga artikel ini bermanfaat bagi anda semuanya.