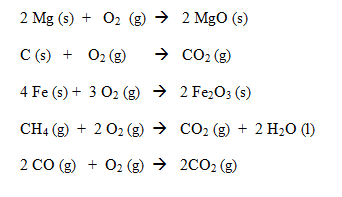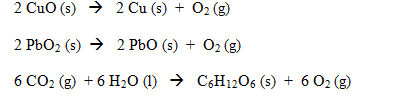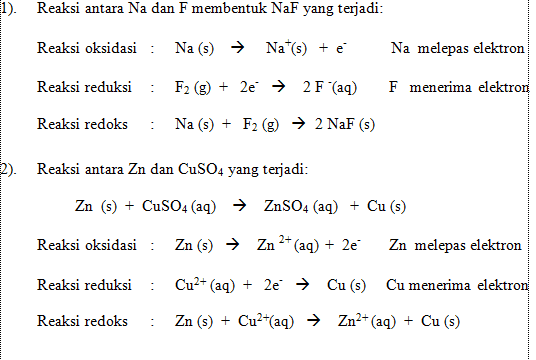Pengertian Reaksi Redoks
Reaksi Redoks adalah persamaan kimia di mana jumlah oksidasi atom yang terlibat dalam reaksi kimia berubah ketika reaksi terjadi. Reaksi tersebut adalah persamaan kimia di mana jumlah oksidasi atom yang terlibat dalam reaksi kimia berubah ketika reaksi terjadi. Definisi ini memperkenalkan kita untuk konsep lain yang mendasar dalam kimia yang sangat penting, bilangan oksidasi. Mari kita mendefinisikannya.
Bilangan oksidasi adalah angka yang persis sama dengan valensi atom tetapi nomor oksidasi membawa tanda dengan itu. Tanda ini mengungkapkan sifat muatan pada spesies yang sesuai ketika terbentuk dari atom netral. Mari kita memahami hal ini melalui contoh. Bilangan oksidasi klorin dalam asam klorida (HCl) adalah -1, asam klor (HClO3) adalah +5 dan asam perklorat (HClO4) itu adalah +7.
untuk menghitung bilangan oksidasi, kita harus mempertimbangkan berbagai bagian oksidasi semua atom dalam molekul dan kemudian menyamakan jumlah semua dari mereka untuk muatan total pada molekul. Ada berbagai aturan untuk mencari bilangan oksidasi atom dalam molekul. Namun, di sini kita hanya akan melihat bagaimana untuk menemukan nomor oksidasi Cl di HClO3.
Contoh Reaksi Redoks
Pembentukan Hidrogen Fluorida
Reaksi: H2 + F2 = 2HF
Zat teroksidasi: Hidrogen
Zat dikurangi: Fluor
Oksidasi Reaksi: H2 → 2H + + 2e –
Pengurangan Reaksi: F 2 + 2e – → 2F –
Dalam reaksi pertama, hidrogen mengoksidasi dengan meningkatkan jumlah oksidasi 0-1 sedangkan pada reaksi kedua, fluor berkurang dengan mengurangi bilangan oksidasi dari 0 sampai -1. Akhirnya, muatan total pada molekul yang terbentuk adalah nol sebagai jumlah elektron yang diperoleh selama oksidasi dikonsumsi selama proses reduksi. Akhirnya, persamaan ternyata,
H2 → 2H+ + 2e – + F2 + 2e- → 2F – = H2+ F2= 2H + + 2F –
H2 + H2 → 2H+ + 2F – → 2HF
Beberapa Contoh lainnya
Beberapa contoh telah disebutkan di sini. Dalam contoh ini, hanya reaksi lengkap telah disebutkan bukan reaksi sel setengah.
Reaksi antara Fe (II) dan CuSO 4 solusi: Fe + CuSO¬4 + → FeSO4 + Cu (Fe teroksidasi, Cu berkurang)
Oksidasi Fe (II) menjadi Fe (III) oleh hidrogen peroksida dan asam: 2 Fe2+ + H2O2 + 2 H + → 2 Fe3+ + 2 H2O
Oksidasi glukosa menjadi karbon dioksida: C6 H12 O 6 + 6 O2 → 6 CO 2 + 6 H2O
Reaksi antara Kalium Permanganat dan Sodium sulfit: 2 KMnO4 + 3 Na 2 SO 3 + H 2 O → 2 MnO 2 + 3 Na 2 SO 4 + 2 KOH
Reaksi asam dan basa: 3 CU + 8 HNO3 → 3 CuSO 4 + 8 NO (g) + 4 H 2 O
Konsep Reaksi Redoks
-
Konsep Reaksi Redoks Berdasarkan Penggabungan dan Pelepasan Oksigen
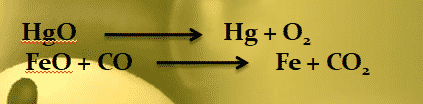
Pada awalnya sekitar abad ke-18, konsep reaksi oksidasi dan reduksi didasarkan atas penggabungan unsur/senyawa dengan oksigen untuk membentuk oksida, dan pelepasan oksigen dari senyawa. Reaksi oksidasi adalah reaksi penggabungan oksigen dengan unsur atau senyawanya seperti pada contoh berikut:
Reaksi reduksi adalah reaksi pelepasan oksigen dari senyawanya seperti contoh berikut:
-
Konsep Reaksi Redoks Berdasarkan Pengikatan dan Pelepasan Elektron
Memasuki abad ke-20, para ahli melihat suatu karakteristik mendasar dari reaksi oksidasi dan reduksi ditinjau dari ikatan kimianya, yaitu adanya serah terima elektron. Reaksi oksidasi melibatkan pelepasan elektron, sedangkan reaksi reduksi melibatkan penerimaan elektron. Konsep ini dapat diterapkan untuk reaksi-reaksi yang tidak melibatkan oksigen.
Reaksi oksidasi adalah reaksi pelepasan elektron, sedangkan reaksi reduksi adalah reaksi penerimaan elektron. Ditinjau dari serah terima elektron, reaksi oksidasi dan reduksi selalu terjadi bersama-sama. Artinya, ada zat yang melepas elektron atau mengalami oksidasi dan ada zat yang menerima elektron atau mengalami reduksi. Reaksi-reaksi berikut menunjukkan terjadinya serah terima elektron.
Bilangan Oksidasi
Untuk menerapkan konsep reaksi oksidasi dan reduksi berdasarkan perubahan bilangan oksidasi, terlebih dahulu harus mengetahui apa itu bilangan oksidasi dan bagaimana cara menentukan harga bilangan oksidasi suatu unsur. Bilangan oksidasi dari suatu atom unsur adalah muatan yang dimiliki oleh atom. Jika elektron valensinya cenderung tertarik ke atom lain yang berkaitan dengannya maka akan memiliki keelektronegatifan relatif lebih besar.
Secara umum, untuk 2 atom yang berkaitan (secara ionik maupun kovalen) berlaku aturan:
- Atom unsur dengan keelektronegatifan yang lebih kecil mempunyai bilangan oksidasi positif.
- Atom unsur dengan keelektronegatifan yang lebih besar mempunyai bilangan oksidasi negatif.
Untuk menentukan bilangan oksidasi atom suatu unsur berlaku aturan berikut:
- Bilangan oksidasi atom dalam unsur bebas sama dengan 0 (nol).
Contoh:
Bilangan oksidasi atom dalam unsur Na, Fe, C, H2, Cl2, P4, dan S8 sama dengan 0 (nol).
- Bilangan oksidasi ion monoatom sama dengan muatan ionnya.
Laporan Bilangan Oksidasi
Membedakan konsep oksidasi reduksi ditinjau dari penggabungan dan pelepasan oksigen, pelepasan dan penerimaan elektron, serta peningkatan dan penurunan bilangan oksidasi
Menentukan bilangan oksidasi atom/unsur dalam senyawa atau ion
Reaksi redoks mengandung dua pengertian, yaitu reaksi reduksi dan reaksi oksidasi. Peengertian reaksi oksidasi dan reaksi reduksi berkembang sesuai dengan perkembangan ilmu kimia.
Perkembangan Reaksi Redoks
Pada awalnya oksidasi adalah reaksi pengikatan oksigen oleh suatu zat.
Contoh
reduksi merupakan reaksi pelepasan oksigen oleh suatu zat
Contoh:
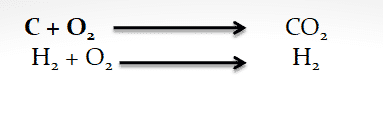
Karena reaksi kimia tidak hanya melibatkan oksigen saja . Misalnya reaksi antara gas klorin dengan natrium.
Kepanjangan Reaksi Redoks
Redoks adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia.
Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana (CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
Istilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi. Ia dapat dijelaskan dengan mudah sebagai berikut:
- Oksidasi menjelaskan pelepasan elektron oleh sebuah molekul, atom, atau ion
- Reduksi menjelaskan penambahan elektron oleh sebuah molekul, atom, atau ion.
Walaupun cukup tepat untuk digunakan dalam berbagai tujuan, penjelasan di atas tidaklah persis benar. Oksidasi dan reduksi tepatnya merujuk pada perubahan bilangan oksidasi karena transfer elektron yang sebenarnya tidak akan selalu terjadi. Sehingga oksidasi lebih baik didefinisikan sebagai peningkatan bilangan oksidasi, dan reduksi sebagai penurunan bilangan oksidasi. Dalam praktiknya, transfer elektron akan selalu mengubah bilangan oksidasi, namun terdapat banyak reaksi yang diklasifikasikan sebagai “redoks” walaupun tidak ada transfer elektron dalam reaksi tersebut (misalnya yang melibatkan ikatan kovalen).
Demikianlah artikel dari duniapendidikan.co.id mengenai Penyetaraan Reaksi Redoks : contoh, Konsep, Bilangan, Pengertian, Perkembangan, Laporan, Kepanjagan, semgoa artikel ini bermanfaat bagi anda semuuanya.