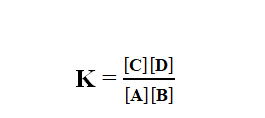Pengertian Kesetimbangan Kimia
Kesetimbangan kimia adalah ilmu yang mempelajari semua proses yang dapat berlangsung dua arah, artinya proses atau reaksi yang dapat balik. Keadaan kesetimbangan kimia diperlihatkan pada contoh dibawah ini :
Ag+ + Fe2+ ↔ Ag + Fe3+
Tanda panah kedua arah yang berlawanan menunjukkan bahwa reaksi dapat dibalik atau terjadi reaksi yang setimbang. Saat keadaan setimbang, tidak akan terjadi perubahan secara makrokopis, artinya perubahan yang dapat diamati atau diukur, tetapi reaksi terus berlangsung dalam dua arah dengan kecepatan yang sama. Jadi kesetimbangan kimia bersifat dinamis, jika ion Ag+ dan Fe2+ dicampur, laju perubahan Ag+ dan Fe2+ setiap saat selalu berubah.
Jika suatu kimia telah mencapai keadaan kesetimbangan maka konsentrasi reaktan dan produk menjadi konstan sehingga tidak ada perubahan yang teramati dalam sistem. Meskipun demikian, aktivitas molekul tetap berjalan, molekul-molekul reaktan berubah mnjadi produk secara terus-menerus sambil molekul-molekul produk berubah menjadi reaktan kembali dengan kecepatan yang sama.
Sedikit sekali reaksi kimia yang berjalan ke satu arah saja, kebanyakan adalah reaksi dapat balik. Pada awal reaksi dapat balik, reaksi berjalan ke arah pembentukan produk. Sesaat setelah produk tersebut, pembentukan reaktan produk juga mulai berjalan. Jika kecepatan reaksi maju dan reaksi balik adalah sama, dan dikatakan bahwa kesetimbangan kimia telah dicapai. Harus diingat bahwa kesetimbangan kimia melibatkan beberapa zat yang berbeda sebagai reaktan dan produk. Kesetimbangan antara dua fase zat-zat yang sama disebut kesetimbangan fisika, perubahan yang terjadi adalah proses fisika.
Jenis Sistem Kesetimbangan
Kesetimbangan Homogen
- Tetapan kesetimbangan
Kesetimbangan homogen adalah suatu kesetimbangan yang hanya terdiri atas satu fasa atau reaksi dalam dimana semua spesies pereaksi ada dalam fase yang sama . Salah satu contoh kesetimbangan homogen yaitu :
H2O + I2 ↔2HI
2SO2 + O2 ↔ 2SO3
Gas A dan B bereaksi membentuk C dan D. Pada saat setimbang, kecepatan reaksi pembentuk gas C dan D adalah sama dengan pembentukan gas A dan B. Reaksi ini dapat dinyatakan dengan persamaan :
A(g) + B(g) ↔ C(g) + D(g)
V1 adalah kecepatan reaksi pembentukan gas C dan D. V2 adalah kecepatan reaksi pembentukan gas A dan B.
Pada saat setimbang :
Harga K adalah tetap pada temperatur tertentu yang sama. Untuk reaksi pada temperatur tetap, secara umum dinyatakan dengan persamaan :
mA + nB ↔ pC + qD
Kp = Kc x (RT)∆n
- Prinsip Le Chatelier
Seorang kimiawan berkebangsaan Perancis, pada tahun 1884, Henri Le Chatelier, menemukan bahwa jika reaks ikimia yang setimbang menerima perubahaan keadaan (menerima aksi dari luar), reaksi tersebut akan menuju pada kesetimbangan baru dengan suatu pergeseran tertentu untuk mengatasi perubahan yang diterima (melakukan reaksi sebagai respon terhadap perubahan yang diterima).
Penerapan Reaksi Kesetimbangan di Industri
-
Pembentukan Amonia Dengan Proses Haber-Bosch
Proses Haber Bosch dalam bidang industri contohnya pada pembuatan amonia (NH3) merupakan senyawa nitrogen yang sangat penting bagi kehidupan, teutama sebagai bahan pembuatan pupuk dan sebagai pelarut yang baik untuk berbagai senyawa ionik dan senyawa polar. Amonia dibuat berdasarkan reaksi antara gas nitrogen dengan hidrogen.
-
Pembentukan Belerang Trioksida (SO3) Pada Proses kontak
2SO2(g) + O2(g) ↔ 2SO3(g) + 42.000 kal
Reaksi ini menyerupai sintesis amonia karena reaksi yang terjadi adalah eksoterm dan terjadi penurunan volume. Untuk mengatasi SO3 yang optimum operasi/reaksi dilakukan pada temperatur rendah, tekanan tinggi, dan gas oksigen atau SO2 berlebihan, tetapi proses tidak ekonomis karena laju reaksinya rendah.
-
Pembentukan Nitrogen Oksida ( Proses Birkland-Eyde )
N2 + O2(g) ↔ 2NO – 43.250 kal
Reaksi pembentukan NO merupakan reaksi eksoterm, maka jika temperatur dinaikkan, kesetimbangan akan bergeser ke arah penyerapan kalor atau ke arah reaksiendoterm. Dengan demikian, pembentukan NO akan bertambah pada kenaikan temperatur. Selain itu, hasil NO semakin bertambah bila gas N2 dan O2 berlebihan.
-
Pembuatan Asam Sulfat Menurut Proses Kontak
Asam sulfat digunakan pada industri baja untuk menghilangkan karat besi sebelum baja dilapisi timah atau seng. Pada pembuatan zat warna, obat-obatan; pada proses pemurnian logam dengan cara elektrolisis; pada industri tekstil, cat, plastik, akumulator, bahan peledak, dan lain-lain. Pendeknya, banyaknya pemakaian asam sulfat di suatu negara telah dipakai sebagai ukuran kemakmuran negara tersebut
Demikianlah artikel dari duniapendidikan.co.id mengenai Kesetimbangan kimia adalah ilmu yang mempelajari semua proses yang dapat berlangsung dua arah, semoga artikel ini bermanfaaat bagi anda semuanya.