Pengertian Ikatan Hidrogen
Hidrogen merupakan unsur yang paling unik, atomnya paling ringan dan paling sederhana yaitu mengandung 1 proton dan 1 elektron. Hidrogen mempunyai densitas atau rapatan paling rendah, bersenyawa dengan hampir setiap unsur lain yang reaktif membentuk senyawa hidrida
Sifat Hidrogen
Hidrogen mempunyai skala elektronegatifitas pertengahan sehingga mempunyai sifat yang bervariasi, yaitu :
- Sangat elektronegatif ( misalnya halogen ) membentuk senyawa polar dengan karakter positif pada atom hydrogen;
- Tetapi juga dengan unsur sangat elektropositif ( misalnya alkali ) membentuk senyawa ionik hidrida dengan karakter negative pada atom hydrogen; 3). Demikian juga dengan unsr intermediate ( misalnya karbon ) membentuk senyawa non polar.
- Molekul hydrogen bersifat non polar mempunyai titik didih rendah ~ 20,4 K dan titik beku ~ 14,4 K sebagai akibat lemahnya gaya-gaya van der waals. Biasanya hydrogen berada dalam bentuk molekul diatomik.
Sifat kimiawi atom hydrogen ditentukan oleh 3 tipe proses elektronik yaitu :
- Kehilangan satu-satunya elektron valensi.
Selanjutnya, bagaimana pengaruh ikatan hidrogen terhadap sifat fisik suatu senyawa ?
Ikatan hidrogen tidak hanya berpengaruh pada titik didih dan titk leleh suatu zat tetapi juga kalarutannya dalam suatu pelarut.
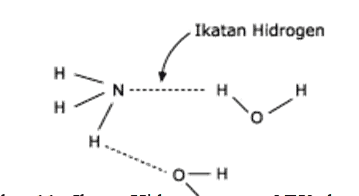
Senyawa yang berikatan hidrogen mudah larut dalam senyawa lain yang juga berikatan hidrogen. Contohnya NH3 dalam H2O seperti pada gambar 11.
Senyawa organik-alkohol, asam karboksilat, amina, glukosa-larut dalam air karena membentuk ikatan hidrogen dengan molekul air.
Senyawa yang memilih ikatan hydrogen akan memilih titik didih lebih tinggi dari pada molekul yang memilih ikatan Van Der Waals atau gaya tarik dipol-dipol. Senyawa hydrida dari unsur golongan IV, V dan VI memilih gaya Van Der Waals yang bertambah dari atas ke bawah setiap golongannya, sehingga titik didih dan titik lelehnya seharusnya meningkat tetepi kenyataannya berbeda.
Senyawa yang memiliki ikatan Hidrogen akan memiliki titk didih dan titik leleh yang lebih tinggi dari senyawa lain yang tidak memiliki ikatan hidrogen
Titik didih H2O lebih tinggi daripada H2S, H2Se dan H2Te. Begitu pula titik didih NH3 lebih tinggi daripada PH3, AsH3, SbH3.
Hal ini ternyata disebabkan terdapatnyan ikatan Hidrogen yang kuat antar molekul-molekulnya
Etanol memiliki titik didih yang sangat tinggi dibandingkan dengan propana walaupun massa molekul relatif (Mr) keduanya tidak jauh berbeda. Hal ini terjadi karena dalam molekul etanol terdapat ikatan hidrogen sedangkan propana tidak. Perhatikan rumus struktur etanol dan propana berikut ini :
Akibat lain dari adanya ikatan hidrogen adalah terjadinya penyimpanan massa molekul relatif. Seperti halnya asam etanoat (asam asetat) atau dalam kehidupan sehari-hari dikenal dengan asam cuka, yang biasa di jumpai dalam wujud larutan tetapi dapat di jumpai dalam wujud gas. Wujud yang terakhir ini terjadi karena du molekul asam cuka bergabung bersama dengan ikatan hidrogen sehingga massa molekul relatifnya (Mr) menjadi 120, dua kali besar dari biasanya yaitu 60.
Senyawa yang membentuk ikatan hidrogen inter molekul akan memiliki titik didih dan titik leleh yang lebih tinggi dibandingkan dengan senyawa yang membentuk ikatan hidrogen intra molekul. Hal ini karena energi kinetik ikatan hidrogen inter molekul lebih besar dari pada ikatan hidrogen intra molokul.
Pengaruh Ikatan Hidrogen Terhadap Titik Didih, Titik Leleh dan Kelarutan Senyawa
Ikatan jenis ini terjadi karena gaya elektrostatik yang khusus antara dipol-dipol. Adanya ikatan hidrigen antarmolekul menyebabkan titik senyawa relatif lebih tinggi dibandingkan dengan senyawa lain yang memilki berat molekul sebanding. Titik didih senyaea golongna alkohol lebih tinggi daripada senyawa golongan alkana, demikian juga titik didih air lebih tinggidaripada aseton.
Pengaruh ikatan hidrogen terhadap titik leleh tidak begitu besar karena pada wujud padat jarak antarmolekul cukup berdekatan dan yang paling berperan terhadap titik leleh adalah berat molekul zat dan bentuk simetris molekul. Senyawa yang mampu membentuk ikatan hidrogen dalam air akan mudah larut dalam air. Panjang atau pendeknya rantao karbon (gugus alkil-R) memiliki pengaruh terhadapkealrutan senyawa dalam air
Gambar Ikatan Hidrogen
Contoh Soal
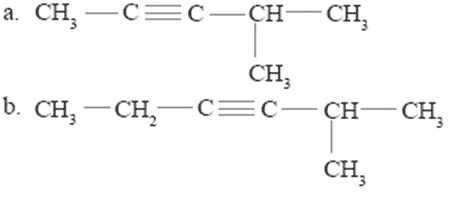
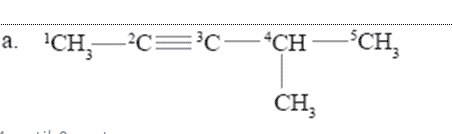
- Tulislah nama senyawa berikut ini.
Jawab
Demikianlah artikel dari duniapendidikan.co.id mengenai Hidrogen merupakan unsur yang paling unik, atomnya paling ringan dan paling sederhana yaitu menga, semoga artikel ini bermafnaat bagi anda semuanya.