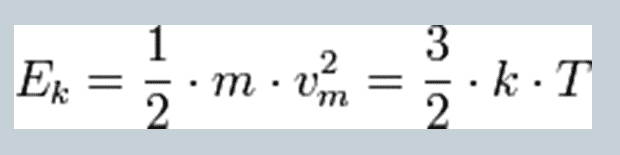Awal Mula Gerak Brown
Pada tahun 1827, ahli Botani bernama Robet Brown berkebangsaan Inggris menggunakan mikroskopnya mampu mengamati pergerakan yang menarik dari serbuk bunga (yang menyebabkan gerakan tersebut) pastilah hidup. Akan tetapi, ketika ia mengganti serbuk bunga dengan serbuk lainnya yang mati, ternyata ia mendapati gerakan yang sama persis.
Dari penelitiannya ini, Brown mendapatkan beberapa fakta menarik terkait sifat gerakan partikel di dalam cairan yang ia teliti, antara lain:
- Gerak partikel tidak pernah berhenti
- Gerak partikel tidak bergantung pada sifat hidup/mati dari medium penampungnya
- Seluruh partikel bergerak secara acak, bahkan dua partikel yang sangat dekat pun tampak independen satu sama lain
- Gerakan yang muncul akan semakin aktif jika ukuran partikel semakin kecil, atau temperatur semakin besar, atau cairan penampung sangat encer
Hanya saja, meskipun Brown mampu menemukan faktor-faktor penting yang mempengaruhi gerak partikel tersebut, ia tidak mengerti apa yang menjadi sebab partikel-partikel berkelakuan seperti yang ia amati
Pengertian Gerak Brown
Sistem koloid juga mempunyai sifat kinetik, selain sifat optik (seperti efek Tyndall). Sifat kinetik ini dapat terjadi karena disebabkan oleh gerakan termal dan gravitasi.
Gerak brown mempunyai hubungan dengan Efek Tyndall, karena menjelaskan penyebab mengapa koloid menyebarkan sinar. Misalnya, bila seberkas sinar dipusatkan pada suatu disperse koloid yang diamati melalui suatu mikroskop berkekuatan tinggi (ultramikroskop), maka akan tampak partikel koloid sebagai partikel kecil uang memantulkan sinar dan bergerak secara acak.
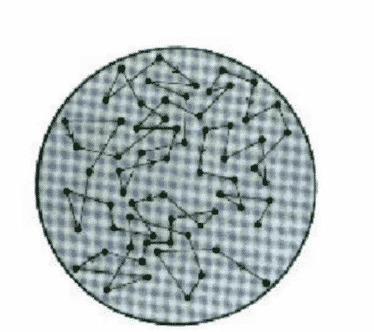
Gerakan tersebut dapat bersifat acak karena adanya benturan/tumbukan tidak teratur atau tidak seimbang dari partikel koloid terdispersi dengan medium pendispersi. Tumbukan antara partikel-partikel tersebut terjadi secara acak dan berlangsung ke segala arah. Untuk koloid dengan medium pendispersi zat cair atau gas, pergerakan partikel-partikel akan menghasilkan tumbukkan dengan partikel-partikel itu sendiri.
Gerak Brown pada sistem koloid menyebabkan partikel-partikel koloid tersebar merata dalam medium pendispersinya. Partikel-partikel koloid bergerak dengan kecepatan berbeda-beda. Gerakan partikelnya akan selalu lurus dan akan patah jika bertabrakan dengan partikel lainnya. Sehingga terdapat suatu resultan tumbukan yang menyebabkan perubahan arah gerak partikel dan kecepatannya, sehingga terjadi gerak zig-zag (gerak Brown). Peristiwa ini bisa kita amati dengan mikroskop ultra.
Gerak ini dapat diamati pada zat cair koloid atau gas. Di dalam suatu ruang pergerakan partikel gas tersebut (analogi terhadap zat cair juga) bergerak bebas dan tidak teratur, dengan kata lain partikel gas itu bergerak dengan kecepatan yang berbeda-beda. Bila partikel gas tersebut menabrak partikel gas lain atau menabrak tembok dinding ruang, maka kecepatan serta arah vektornya ikut berubah. Penyebaran kecepatan ini dapat dirumuskan dengan penyebaran kecepatan Maxwell yang memberikan gambaran bahwa kecepatan partikel tergantung dari temperatur ruang dan lingkungannya.
Kecepatan rata-rata pergerakan molekul di udara adalah 500m/s atau 1800 km/h. Kecepatan ini melebihi kecepatan gelombang suara yang besarnya 330 m/s. Energi dari partikel gas ideal juga tergantung dari suhu udara.
Teori gas kinetik memberikan hubungan proporsional antara energi rata-rata kinetik dengan temperatur gas:
Faktor-faktor yang Mempengaruhi Gerak Brown
- Suhu (T) : semakin tinggi susu sistem koloid, maka semakin besar energi kinetik yang dimiliki partikel-partikel medium pendispersinya. Akibatnya, gerak Brown dari partikel-partikel fase terdispersinya semakin cepat. Demikian pula sebaliknya, semakin rendah suhu sistem koloid, maka gerak Brown akan semakin lambat.
- Partikel (α) : semakin kecil ukuran partikel koloid, maka semakin cepat gerak brown. Sebaliknya semakin besar ukuran partikel koloid, maka semakin lambat gerak Brown. Hal ini menjelaskan mengapa gerak Brown sulit diamati dalam larutan dan tidak ditemukan dalam zat padat (suspensi).
- Visikositas (η) : semakin kecil visikositas /kekentalan maka gerak Brown semakin cepat. Sebaliknya semakin besar visikositas kekentalan maka gerak Brown semakin lambat.
Contoh Gerak Brown dalam kehidupan sehari-hari
-
Susu
Gerak Brown yang paling mudah dipahami adalah pada susu. Apabila susu didiamkan untuk waktu beberapa lama, tidak akan didapati endapan.
Demikianlah artikel dari duniapendidikan.co.id mengenai Gerak Brown : Pengertian, Faktor Yang Mempengaruhi, Contoh, dan Awalmulanya, semoga artikel ini bermanfaat bagi anda semuanya.