Pengertian Air
Air adalah zat atau materi atau unsur yang penting bagi semua bentuk kehidupan yang diketahui sampai saat ini di bumi. Air dalam bentuk cair adalah tidak bewarna, tidak berbau, tidak mempunyai rasa dan merupakan senyawa yang sukar dimampatkan yang memiliki beberapa sifat yang khas. Sifat – sifat air terdiri dari sifat kimia dan fisik.
Struktur dan komposisi Air
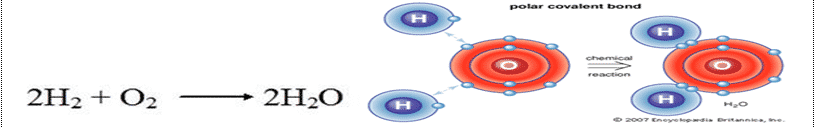
Air adalah molekul sederhana yang terdiri dari satu atom oksigen terikat pada dua atom hidrogen yang berbeda. Karena elektronegativitas lebih tinggi dari atom oksigen, ikatan tersebut adalah kovalen polar (ikatan polar).
Bagi setiap 1 molekul air, ada 2 atom hidrogen yang telah bergabung dengan 1 atom oksigen. Komposisi air atau kandungan air ini boleh diuraikan semula kepada bahan asas nya melalui proses elektrolisis. Elektrolisis adalah proses menguraikan elektrolit (dalam kes ini adalah air) kepada komponen asalnya, iaitu oksigen dan hidrogen.
Komposisi 1 molekul air yang terbentuk daripada gabungan 1 atom oksigen dan 2 atom hidrogen.
Dibutuhkan dua molekul gas hidrogen diatomik, dikombinasikan dengan satu molekul dari gas oksigen diatomik untuk menghasilkan dua molekul air. Dengan kata lain rasio hidrogen terhadap oksigen adalah 2:1, rasio hidrogen terhadap air adalah 1:1, dan rasio oksigen ke air adalah 1:2.
Sifat Kimia Air
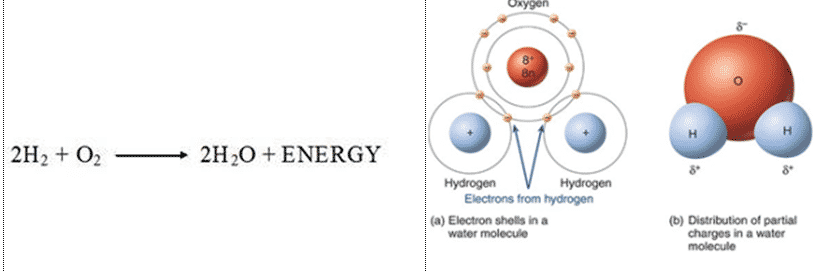
Sebuah molekul air terdiri dari sebuah atom oksigen yang berikatan kovalen dengan dua atom hidrogen. Hidrogen dan oksigen mempunyai daya padu yang sangat besar antara keduanya. Semua atom dalam molekul air terjalin menjadi satu oleh ikatan yang kuat, yang hanya dapat dipecahkan oleh perantara yang paling agresif, misalnya dengan menggunakan energi listrik atau beberapa zat kimia.
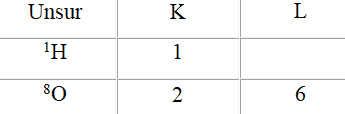
Sebuah atom oksigen (O)mempunyai sebuah inti dengan delapan proton yang terletak pada orbital kulit K (2) dan kulit L (6), jadi belum penuh dan membutuhkan 2 elektron untuk kestabilannya. Sedangkan sebuah atom hidrogen (H) mempunyai kulit elektron tunggal disekeliling intinya dengan satu elektron, jadi masih kekurangan satu elektron. Kulit yang belum terisi penuh tersebut tidak mantap sehingga elektron-elektronnya cepat bergabung dengan elektron yang lain untuk mencapai kestabilan dalam kulit, karena kulit yang terisi penuh merupakan bentuk yang mantap (stabil dalam orbital).
Sifat Fisik Air
-
Eletrolisis Air
Molekul air dapat diuraikan menjadi unsur-unsur asalnya dengan mengalirinya arus listrik. Proses ini disebut elektrolisis air. Pada katode, dua molekul air bereaksi dengan menangkap dua elektron, tereduksi menjadi gas H2 dan ion hidroksida (OH–). Sementara itu pada anode, dua molekul air lain terurai menjadi gas oksigen (O2), melepaskan 4 ion H+ serta mengalirkan elektron ke katode. Ion H+ dan OH– mengalami netralisasi sehingga terbentuk kembali beberapa molekul air.
-
Kelarutan (solvasi)
Air adalah pelarut yang kuat, melarutkan banyak jenis zat kimia. Zat-zat yang bercampur dan larut dengan baik dalam air (misalnya garam-garam) disebut sebagai zat-zat “hidrofilik” (pencinta air), dan zat-zat yang tidak mudah tercampur dengan air (misalnya lemak dan minyak), disebut sebagai zat-zat “hidrofobik” (takut-air). Kelarutan suatu zat dalam air ditentukan oleh dapat tidaknya zat tersebut menandingi kekuatan gaya tarik-menarik listrik (gaya intermolekul dipol-dipol) antara molekul-molekul air. Jika suatu zat tidak mampu menandingi gaya tarik-menarik antar molekul air, molekul-molekul zat tersebut tidak larut dan akan mengendap dalam air (Nur, 1990).
-
Kohesi dan Adhesi
Air menempel pada sesamanya (kohesi) karena air bersifat polar. Air memiliki sejumlah muatan parsial negatif (σ-) dekat atom oksigen akibat pasangan elektron yang (hampir) tidak digunakan bersama, dan sejumlah muatan parsial positif (σ+) dekat atom oksigen. Dalam air hal ini terjadi karena atom oksigen bersifat lebih elektro negatif dibandingkan atom hidrogen yang berarti, ia (atom oksigen) memiliki lebih “kekuatan tarik” pada elektron-elektron yang dimiliki bersama dalam molekul,
menarik elektron-elektron lebih dekat ke arahnya (juga berarti menarik muatan negatif elektron-elektron tersebut) dan membuat daerah di sekitar atom oksigen bermuatan lebih negatif ketimbang daerah-daerah di sekitar kedua atom hidrogen. Air memiliki pula sifat adhesi yang tinggi disebabkan oleh sifat alami ke-polar-annya (Kay, 1966).
-
Tegangan Permukaan
Air memiliki tegangan permukaan yang besar yang disebabkan oleh kuatnya sifat kohesi antar molekul-molekul air. Hal ini dapat diamati saat sejumlah kecil air ditempatkan dalam sebuah permukaan yang tak dapat terbasahi atau terlarutkan (non-soluble); air tersebut akan berkumpul sebagai sebuah tetesan. Di atas sebuah permukaan gelas yang amat bersih atau bepermukaan amat halus air dapat membentuk suatu lapisan tipis (thin film) karena gaya tarik molekular antara gelas dan molekul air (gaya adhesi) lebih kuat ketimbang gaya kohesi antar molekul air.
-
Pembekuan dan Struktur Es
Molekul air dapat mengikat empat molekul air dan menghasilkan kisi kristal heksagonal dalam es. Sifat ikatan hidrogen lain yang juga penting ialah bahwa ikatan ini terarah dengan baik dilihat dari susunan gabungan orbital antara atom hidrogen dan atom oksigen. Panjangnya ikatan hidrogen yang berbeda-beda sangat bergantung pada struktur geometri dan distribusi elektronnya.
Bentuk es misalnya, tiap molekul air memiliki ikatan hidrogen dengan panjang 1,77 Å, tiap molekul air berikatan hidrogen dengan 4 tetangganya dengan jarak antara oksigen dengan oksigen 2,76 Å, sedangkan tiap molekul air akan berikatan hidrogen dengan 3 atau 4 molekul air lainnya dengan jarak oksigen ke oksigen 2,90 Å pada suhu 15 0C, dan 3,05 Å pada suhu 83 0C.
-
Interaksi Hidrofobik
Air dapat mendispersi senyawa amfipatik (senyawa dengan gugus hidrofobik dan gugus hidrofilik) yang mempunyai gugus polar dalam molekulnya misalnya pada asam lemak. Sebagai contoh ialah garam Na-oleat.
Natrium oleat mempunyai rantai hidrokarbon yang panjang, sehingga dapat dikatakan kecenderungan untuk terdispersi dalam air sangat sukar, tetapi kenyataannya bahwa rantai hidrokarbon yang panjang ini akan terdispersi di dalam air membentuk misel (disini air yang bersifat polar tidak melarutkan rantai hidrokarbon nonpolar pada asam oleat, sehingga terbentuklah misel) .
Dalam hal ini, gugus karboksilnya yang bermuatan negatif timbul di permukaan sedangkan rantai hidrokarbon yang nonpolar dan tidak larut berada dibagian dalam. Dalam bentuk misel, ada gaya tarik sesamanya melalui suatu interaksi Van der Walls yakni antara rantai hidrokarbon yang berdekatan, gaya tarik ini dikenal sebagai interaksi hidrofobik. Contoh lain komponen sel yang membentuk struktur nonpolar dengan bagian hidrofobiknya tersembunyi dari air adalah protein dan asam nukleat (Murray, 2006).
Unsur Air
- Unsur-unsur utama dalam siklus hidrologi :
- Evaporasi: penguapan dari badan air secara langsung
- Transpirasi: penguapan air yang terkandung dalam tumbuhan
- Respirasi: penguapan air dari tubuh hewan dan manusia
- Evapotranspirasi: perpaduan evaporasi dan transpirasi
- Kondensasi: proses perubahan wujud uap air menjadi titik-titik air sebagai hasil pendinginan
- Presipitasi: segala bentuk curahan atau hujan dari atmosfer ke bumi yang meliputi hujan air, hujan es, hujan salju
- Infiltrasi: air yang jatuh ke permukaan tanah dan meresap ke dalam tanah
- Perkolasi: air yang meresap terus sampai ke kedalaman tertentu hingga mencapai air tanah atau groundwater
- Run off: air yang mengalir di atas permukaan tanah melalui parit, sungai, hingga menuju ke laut
Fungsi Air
-
Air Sebagai Pelarut
Dalam bentuk dispersi koloid, dimana partikel tidak mengendap maupun membentuk larutan. Protein senyawa yang dapat membentuk dispersi koloid, gelatin akan membentuk dispersi koloid bila ditambahkan air panas. Dalam suspensi, partikel bahan mempunyai ukuran yang besar, sehingga tidak larut dan tidak membentuk koloid, misalnya pati dalam air dingin.
Air mendispersi/melarutkan berbagai zat berdasarkan sifat dwi kutubnya, seperti NaCl (membentuk ion) selanjutnya beberapa zat yang tidak membentuk ion tapi termasuk dalam senyawa polar seperti aldehida, alkohol, dan gula dapat larut dalam air. Kelarutan dari zat seperti di atas disebabkan oleh adanya gugus hidroksil (alkohol dan gula) dan gugus oksigen karbonil (aldehida dan keton) (Kay, 1966).
-
Air Sebagai Nutrisi Tubuh Paling Vital
Manusia dapat bertahan hidup selama beberapa minggu tanpa makanan, tetapi hanya dapat bertahan beberapa hari tanpa air. Tubuh manusia terdiri atas 55-75 persen air. Air menjadi salah satu unsur pembentuk dasar darah, enzim-enzim pencernaan, urin, keringat, dan bahkan terkandung dalam jaringan otot, lemak, dan tulang.
Karena tubuh tidak dapat menyimpan air, maka kita memerlukan asupan air segar untuk mengganti air yang sudah dikeluarkan berbagai organ vital tubuh menjadi keringat, urin, kotoran, dan lain-lain. Jumlah asupan air yang kita butuhkan bergantung pada metabolisme tubuh kita, suhu udara, cuaca, makanan yang kita konsumsi dan tentunya tingkat aktifitas yang dilakukan (Winarno, 1989).
Air berfungsi sebagai bahan yang dapat mendispersikan berbagai senyawa yang ada dalam bahan, air dapat melarutkan berbagai bahan seperti garam, vitamin yang larut dalam air, mineral, dan senyawa cita rasa seperti yang terkandung dalam teh dan kopi. Ion H+ dan ion OH– sangat menentukan sifat biologis dan strukur molekul yang ada di dalamnya seperti protein, lipid, dan komponen sel lainnya (Girindra, 1986).
Senyawa Air
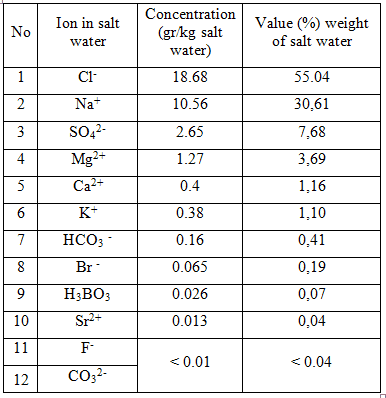
Kandungan senyawa kimia utama dalam air laut (salt water salinity = 35 %)
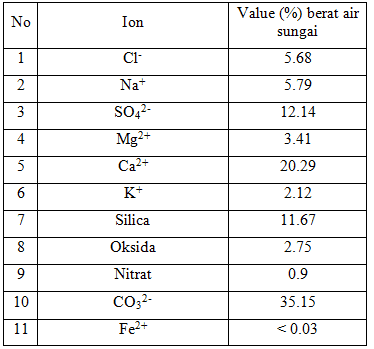
. Kandungan senyawa kimia utama dalam air sungai
Demikianlah artikel dari duniapendidikan.co.id mengenai Apa Fungsi Air Bagi Manusia : Struktur, Sifat, Kimia, Pengertian, Unsur, Senyawa, semoga artikel ini bermanfaat bagi anda semuanya.